荣格工业资源APP
了解工业圈,从荣格工业资源APP开始。
孙正旺,皮肤学博士,韩国庆熙大学药学博士、韩国延世大学医学博士、哈佛大学皮肤免疫学博士,现就职于北美排名第一的综合研究型医院——麻省总医院,麻省总医院是哈佛大学医学院下属的教学医院。
皮肤作为机体抵御外界有害物质入侵的初始屏障,也是一个富含各种免疫细胞的免疫器官。

从解剖学来讲,哺乳动物皮肤可以分为三层,表皮层,真皮层和皮下组织。这些免疫细胞有序地分布在皮肤的不同层次里,和非免疫细胞如角质细胞、成纤维细胞、上皮细胞和脂肪细胞以及神经元建立通讯网络,形成保护屏障(图1)。
随着年龄的增长,皮肤的外观和功能会发生变化,称为内在或自然老化,并且这些变化会因外部暴露因素(例如 UV)而加剧,同时,免疫功能也会衰退,包括适应性免疫力下降,称为免疫衰老,其特征是免疫系统对外界异物入侵做出有效反应的能力下降。免疫衰老伴随着慢性、低度全身性炎症,称为炎症老化,表现为血清中炎症细胞因子(如 IL-6、IL-8 和 TNF-α)的水平升高。 这些炎症因子可以激活先天免疫细胞和非免疫细胞,诱导它们分泌过量细胞因子,导致功能失常。然而,人们对炎症如何导致皮肤老化知之甚少。
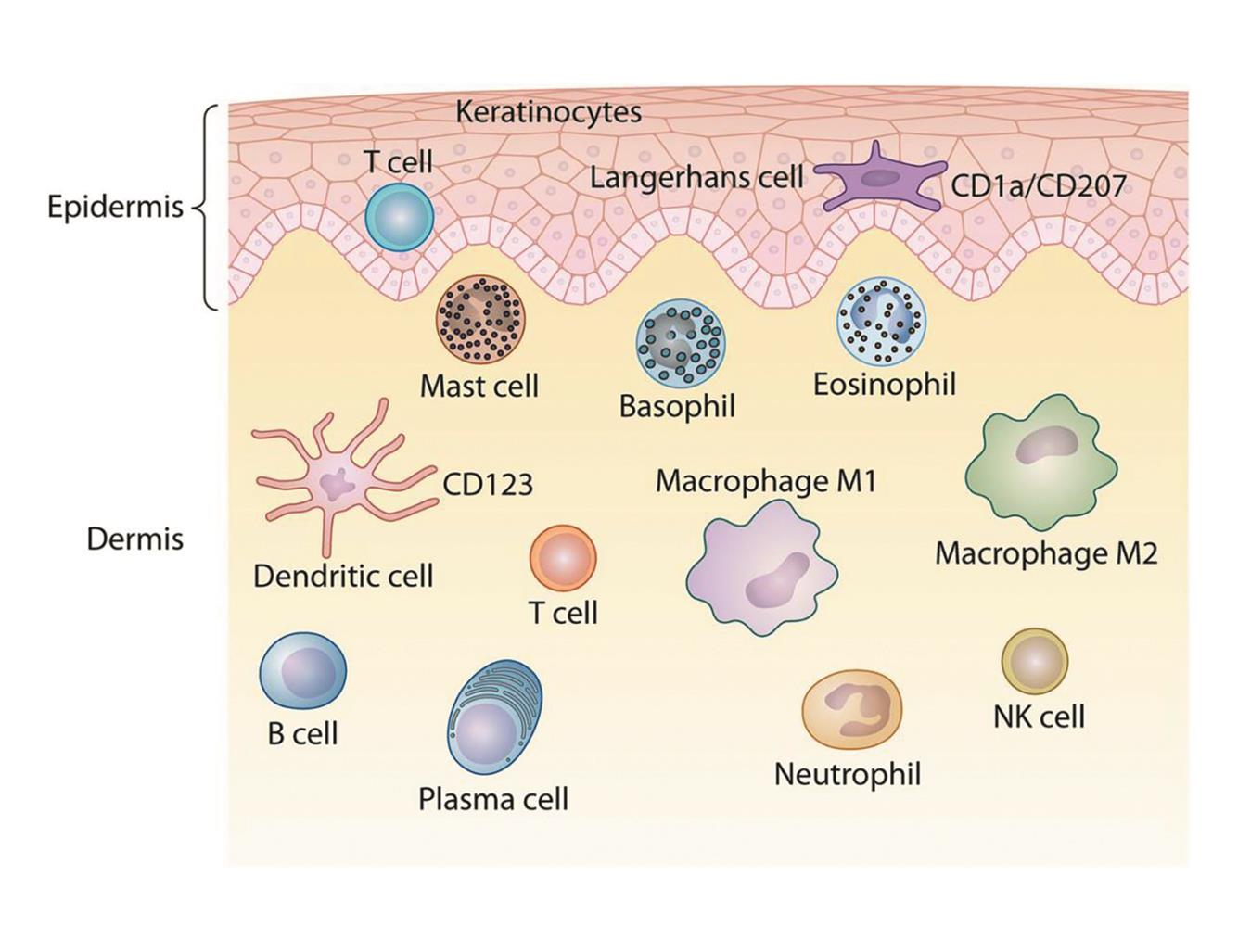
图1. 皮肤免疫细胞分布图
(图片来源 PMID:31366611)
本文将通过讨论自然老化皮肤中的炎症表型,关注细胞衰老在诱导炎症,导致皮肤老化过程中的重要作用,来进一步了解炎症与老化的关系。
一、细胞衰老和皮肤炎症老化
衰老是导致老年病的主要原因,但在正常的组织生理学中也起着至关重要的作用,如防止伤口愈合中的纤维化,抑制肿瘤形成等。现有研究表明,端粒缩短,基因组不稳定,压力和致癌基因的激活,皮肤持续暴露于紫外线辐射和污染等外部压力源累积的环境因素都可诱导衰老。衰老细胞的积累则诱发慢性炎症和代谢功能障碍,从而加剧衰老过程。当衰老细胞在皮肤中聚集,尽管他们无法分裂,但仍保持代谢活跃,表现出变化了的分泌组,称为衰老相关分泌表型(SASP),其中包含显著改变皮肤微环境的促炎细胞因子。
1. 成纤维细胞衰老与皮肤炎症老化
预防成纤维细胞的衰老是延缓皮肤老化的一个普遍机制,且可以在药理学上用于改善老年人的皮肤健康。真皮成纤维细胞是通过分泌、重塑细胞外基质来维持皮肤健康和伤口愈合功能的,然而,老化的皮肤成纤维细胞富含包括促炎细胞因子、趋化因子和蛋白酶的SASP,可促进ECM重塑,是导致与年龄相关的皮肤外观和功能变化的一个主要原因。同时,老化的皮肤成纤维细胞表达更高水平的CCN1,驱动IL-1β 和 IL-6 的表达,破坏胶原蛋白稳态。老化的皮肤成纤维细胞也会增加人类皮肤的脆弱性,有报道称,衰老相关色素沉积是由成纤维细胞衰老通过抑制SDF-1表达驱动的。
2. 角质细胞衰老与皮肤炎症老化
衰老的角质细胞也会随着年龄增长而增多,然而我们对其分泌的蛋白质库的变化知之甚少。 有报道称,衰老角质细胞的 IL-1α 分泌更高,这一特征可能是由于其持续诱导的炎症引起的。IFN-α2、EGF、和 IL-1 受体拮抗剂在老化皮肤中明显较低,而皮质醇较高。最近,发现许多与慢性炎症相关的新型角质层蛋白在老化皮肤中上调,包括 ORM1。 也有人提出,细胞衰老是一种应对细胞损伤和压力的有益的补偿机制,只有在与祖细胞耗竭,和细胞更新减少同时发生时才是有害的。总体而言,衰老对机体的影响似乎取决于组织,在复杂的组织中可能会根据特定的情形和条件而有所不同,例如皮肤。
二、皮肤免疫细胞与皮肤炎症老化
皮肤含有多种免疫细胞,这些免疫细胞是健康组织功能不可或缺的组成部分。
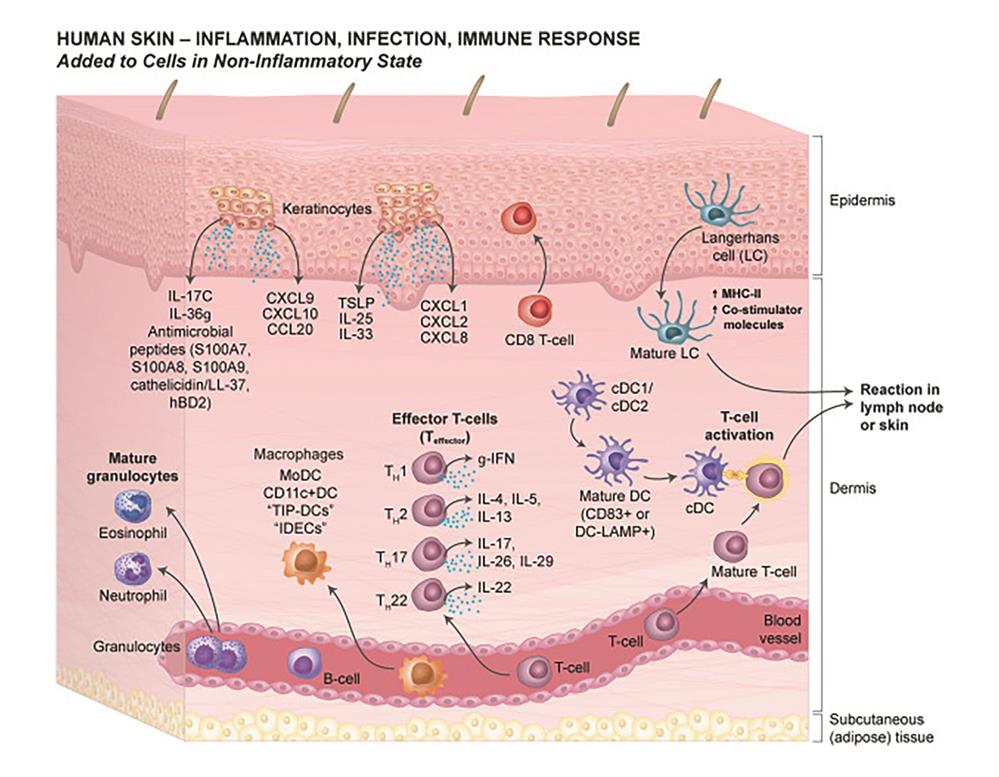
图2. 皮肤免疫反应
(图片来源 PMID: 30954522)
当皮肤受到外界细菌,病毒,或者有毒物质入侵时,会引发机体免疫反应,导致炎症发生。
具体就是,在皮肤免疫细胞检测到炎症信号时,皮肤会从耐受性状态转变为免疫原性状态。 皮肤朗格汉斯细胞被激活并迁移到真皮和/或淋巴结以激活效应 T 细胞反应;真皮中树突状细胞也被大量激活,产生细胞因子激活特定效应T 细胞亚群;角质形成细胞增殖并产生细胞因子和趋化因子,这些细胞因子和趋化因子有助于提高特定效应免疫反应;趋化因子引导嗜中性粒细胞、嗜酸性粒细胞、T 细胞、 树突状细胞(DC)、自然杀伤细胞 (NK)、自然杀伤性T 细胞(NKT)等离开脉管系统,渗入局部组织,并聚集在炎症部位,产生疾病特异性免疫反应 (图2)。抗原是否激活免疫反应的临界点可能是由“先天性”局部炎症水平引起的。
接下来,我们就来看看衰老过程中一些关键免疫细胞的变化是如何导致皮肤炎症老化的?
1. 朗格汉斯细胞(LC)
朗格汉斯细胞 (LC)存在于老化的表皮中,通过迁移到皮肤区域淋巴结传导免疫反应,或通过激活效应或调节性 T 细胞,促进对自身抗原的耐受性,其数量少于年轻皮肤中的细胞。
目前,关于老化皮肤中LCs数量减少的潜在原因尚不明确,但由于其在稳态条件下靠局部自我增殖来维持稳定,且在老年人中,LCs 也不太能够响应创伤或 TNF-α (一种关键的朗格汉斯细胞动员信号) 的刺激而从表皮中迁移出来,所以推测可能是其原位祖细胞增殖减少造成。 这种迁移缺陷被归因于局部 IL-1β 的可用性降低,因为体内或者体外实验证明在加入这种细胞因子后,LCs能够恢复迁移。
据报道,LCs还参与维持表皮屏障, LCs是表皮中抗菌肽 hBD3 的主要来源,它们在老化皮肤中的数量减少可能导致抗菌和肿瘤细胞防御能力减弱, hBD3 可以调节角质细胞的紧密连接程度,可增加表皮厚度并减少皱纹。
2. T细胞
关于衰老过程中皮肤组织固有记忆 T 细胞的变化,我们也知之甚少。 据报道,老年受试者的皮肤 CD4+ 与 CD8+ T 细胞比率高于年轻受试者,并且 CD4+CD28- T 细胞在老年皮肤中没有增加。此外,在老化的皮肤中,Tregs 数量和免疫抑制受体 PD-1 的表达明显增加,并且可能帮助抑制适应性免疫反应。 在我们的研究中,我们发现 CD4+ T 细胞数量没有年龄差异,但与年轻皮肤相比,CD8+ T 细胞在老年人中有所增加。这些变化可能是由于表皮屏障功能受损或成纤维细胞衰老引起的炎症加剧,但也可能促进炎症微环境的形成。
3.皮肤炎症老化与适应性免疫
对老龄皮肤中水痘-带状疱疹病毒 (VZV) 反应的检查表明,CD4+和CD8+ T细胞的浸润减少,而先天炎症通路和促炎细胞因子的产生增加。 抑制促炎信号级联反应中的关键蛋白激酶 p38-MAPK,可减少全身炎症标志物,如 CRP,并增加老龄皮肤对 VZV 的适应性免疫反应。有趣的是,p38-MAPK在应激诱导的成纤维细胞衰老中具有关键作用,表明其可能参与老化皮肤适应性免疫失调,并且p38-MAPK 抑制剂可以抑制成纤维细胞SASP。老化皮肤的皮下注射创伤会导致衰老的成纤维细胞分泌CCL2,招募分泌前列腺素E2的单核细胞,并抑制皮肤固有记忆T细胞增殖。而阻断p38-MAPK通路, 抵消了这些影响,并增强了老化皮肤中 VZV 特异性T细胞的增殖。
在老化的皮肤中,B淋巴细胞反应也会受到影响,B细胞存在于健康皮肤中,并通过将抗原呈递给浆细胞和T 细胞来促进免疫防御。B细胞分泌促炎细胞因子,如IL-6,诱发炎症并引发过敏和自身免疫,然而,它们也具有抗炎和稳态作用,例如调节皮肤微生物组、屏障功能和伤口愈合。因此,有必要进一步探索皮肤炎症与B细胞活性之间的关系。
然而,炎症和免疫衰老之间的循环关系使得其很难确定在衰老过程中哪个先发生。更新的炎症和免疫衰老理论表明,炎症反应的改变可能是衰老机体在缺乏有效适应性免疫的情况下增强先天免疫的一种适应。此外,衰老皮肤中衰老免疫细胞的积累可能导致炎症异常,并在一定程度上阻止了适应性免疫和有效的免疫监视机制。
三、小结
综上,我们了解到源自衰老细胞的促炎性皮肤环境造成了皮肤 ECM 的损伤和重塑,破坏了适应性免疫,这不仅会导致皮肤结构和临床外观的改变,还可能直接影响皮肤驻留和浸润免疫细胞,以及老年人的免疫能力。免疫细胞的积累和不适当的适应性免疫反应可能促进衰老皮肤细胞的存活以及细胞外基质的破坏和重塑。探索皮肤成纤维细胞和免疫细胞在衰老过程中的关系将加深我们对这些细胞如何相互影响的理解,并可能为保持皮肤健康提供新的思路。尽管抑制炎症可能有助于提高疫苗效力,但最终可能需要更全面的方法来重新平衡老化皮肤的炎症通路和组织再生。细胞衰老、炎症和皮肤功能之间的关系在我们的一生中可能会被周期性放大,以免疫监视、激素反应和抗炎信号为目标的衰老药物和疗法的组合可以建立老化皮肤的适应性稳态,从而促进改善皮肤老化。
原文有删节,更多阅读请移步荣格个人护理公众号
及荣格工业传媒官网
来源:荣格-《国际个人护理品生产商情》
原创声明:
本站所有原创内容未经允许,禁止任何网站、微信公众号等平台等机构转载、摘抄,否则荣格工业传媒保留追责权利。任何此前未经允许,已经转载本站原创文章的平台,请立即删除相关文章。