荣格工业资源APP
了解工业圈,从荣格工业资源APP开始。
1.前言
根据世界卫生组织的预测数据,全球60岁以上的人口将从2020年的10亿人增加一倍,到2050年的21亿人而占总人口的六分之一。[1]衰老相关疾病已成为全球社会经济负担和重大卫生健康挑战。促进“健康老龄化”显得尤为重要。而皮肤与头发的美容保健就是一种积极的“健康老龄化”行为。
自噬调控是抗衰老的重要潜在手段之一。自噬作为一种细胞内部的清理机制,被认为可以将细胞内部的垃圾及老化的细胞器分解并回收,从而维持细胞的正常代谢与生存。近年来,越来越多的研究表明,自噬在色素沉着、细胞分化、屏障形成、抗原呈递、病原体清除、炎症消解和伤口愈合等方面发挥着重要作用。[2]自噬与皮肤老化及皮肤疾病密切相关,自噬机制的失调已成为老化的主要特征之一。将自噬调控原理用于老化干预的手段正在成为抗衰老化妆品研究领域的一个新热点。
本文简要地说明自噬及其分类、分子机制、调控通路和检测方法,重点介绍皮肤细胞的自噬作用与皮肤老化的关系,以及自噬调控在肌肤抗老化、美白、抗皱、头皮抗衰老、防脱育发领域的应用基础研究成果。
2.关于自噬
2.1. 自噬及其分类
1882年出生于乌克兰的俄国微生物学家与免疫学家伊里亚•伊里奇•梅契尼可夫发现了吞噬细胞,并因吞噬作用(一种由白血球执行的免疫方式)的研究,而获得1908年诺贝尔生理学或医学奖。[3]但吞噬细胞是如何完成吞噬作用的呢?
上世纪60年代比利时科学家克里斯蒂安•德•迪夫(Christian de Duve)发现细胞能够将自身的组分用膜包起来,形成袋状囊泡并运送到溶酶体(Lysosome)降解掉而发明了(AUTOPHAGY)“自噬”一词,也因发现这种新型细胞器—溶酶体而获得了1974年诺贝尔生理学或医学奖。[4] 但直到 20世纪 90 年代,随着自噬酵母模型的建立和自噬相关基因 (autophagy-related gene,ATG) 的发现,有关自噬复杂机制的研究才取得了重大突破。[5] [6]日本科学家大隅良典也因其“对细胞自噬机制的发现”获得2016年度的诺贝尔生理学或医学奖。[7]
自噬是细胞对持续性内外刺激的非损伤性应答反应,以维持细胞结构、代谢和功能的平衡。根据底物进入溶酶体途径的不同,可将自噬分为巨自噬(macro -autophagy以下简称自噬)、微自噬(microautophagy)和分子伴侣介导的自噬((chaperone-mediated autophagy, CMA))。其中研究最多的巨自噬(图一) ,涉及自噬诱因细胞信号、自噬膜的来源和组装,自噬标记蛋白ATG和吞噬底物的特定识别,组装完成的自噬体外膜和溶酶体的对接融合,成形自噬溶酶体内含物的降解,降解产物的代谢循环。产生的分解产物通过渗透酶释放回胞浆中,并被回收。游离氨基酸和脂肪酸被用作新蛋白质合成和ATP生产的原料,促进细胞和整个生物体水平的稳态和生存。
诱导自噬的关键调节因子是 mTOR 激酶。它通过激活 mTOR(Akt 和 MAPK 信号)抑制自噬或通过抑制 mTOR(AMPK 和 p53 信号)诱导自噬。 ULK 起着与酵母 Atg1 相似的作用,作用于 mTOR 复合体的下游。 ULK 与 Atg13 和支架蛋白 FIP200 形成一个大的复合体。 III 类 PI3K 复合物或紫外线辐射抗性相关基因 (UVRAG) 包含 hVps34、Beclin-1(酵母 Atg6 的哺乳动物同源物)、p150(酵母 Vps15 的哺乳动物同源物)和 Atg14 样蛋白(Atg14L 或 Barkor)是必需的诱导自噬。 Rubicon 抑制 PI3K III 类脂质激酶的活性,还抑制 Atg14L 的活性,Atg14L 是 PI3K III 类活性的增强剂。Atg 基因通过 Atg12-Atg5 和 LC3-II (Atg8-II) 复合物控制自噬体的形成。自噬和细胞凋亡呈正相关和负相关,并且两个过程之间存在广泛的串扰。几种促凋亡信号如 TNF、TRAIL 和 FADD 也可诱导自噬。 此外,Bcl-2 抑制 Beclin-1 依赖性自噬,从而作为促生存因子和抗自噬调节剂发挥作用。
巨自噬最初被认为是一种非选择性的总体降解过程。然而,第一个选择性自噬受体p62/SQSTM1的发现改变了这一观念。[8] [9]过去20年的很多发现指向自噬可能是一种与维持细胞组织稳态相关的高度选择性细胞代谢途径。[10] [11]选择性自噬可以根据所涉及的特定研究对象进一步分为许多亚型。这些亚型分别参与各种细胞内物质的降解,如各种大分子(糖噬和脂噬),线粒体(线粒体自噬),内质网(ER)(内质网自噬),部分细胞核(细胞核自噬),病原体(异源自噬)和溶酶体本身(溶酶体自噬)。 [12]
2.2. 自噬的分子生物学检测方法 [2] [12]
为了研究自噬的分子生物学过程,人们根据特定研究对象建立了不同研究模式,而这些模型又主要集中于检测和量化自噬的生物标志物,如自噬相关蛋白ATG,自噬标志性蛋白LC3(microtubule-associated protein 1light chain 3),Beclin 1,p62等。
LC3和p62的分析是评估自噬的常用方法,而自噬可以通过靶向自噬体形成或溶酶体融合来调节。常用的调节自噬的技术包括:自噬调节蛋白的基因消融或使用小分子抑制剂,使用溶酶体抑制剂或细胞毒性自噬激活剂等。
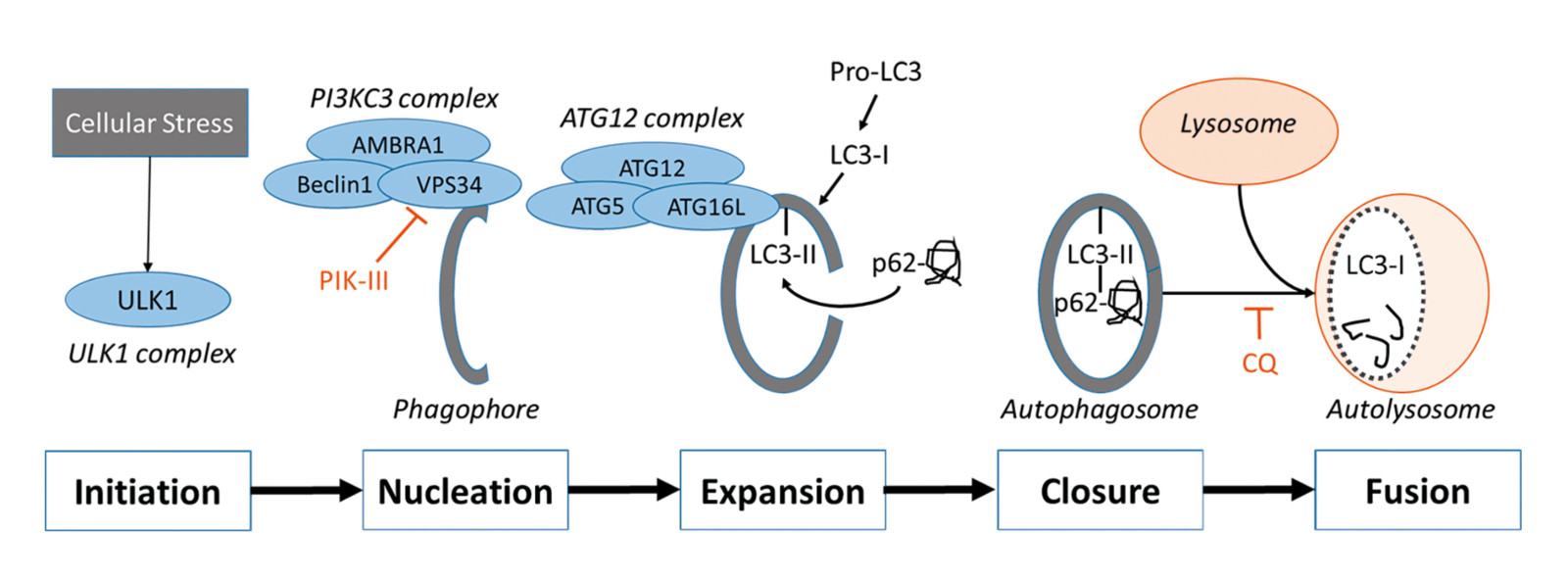
图1.自噬的简化示意图。[2]
根据研究对象和目的不同,自噬的检测方法也会不同。静态检测法通常使用透射电子显微镜调查记录特定时间点细胞自噬的形态学特征,或者将自噬相关标记蛋白如LC3免疫染色后用荧光显微镜观察、计算辉点定量。在自噬不同阶段,静态检测法检测结果可能差别较大。因为无法辨别是因诱导了自噬而使自噬体增加了还是自噬的最终分解阶段被阻碍而使自噬体增加了,自噬体数量的变化不能代表自噬的活性。
自噬活性大多需要通过动态检测方法,即定量相关蛋白自噬通量来确定。自噬小体形成时,胞浆型LC3-I被半胱氨酸蛋白酶切去掉一小段多肽的LC3被称作胞浆型LC3-I,与自噬体的膜构成成分的磷脂酰乙醇胺结合后成为膜型LC3-II。这样,LC3-II/I比值的大小可估计自噬水平的高低。自噬体一旦与溶酶体融合LC3-Ⅱ 就会被分解。如果使用溶酶体阻碍剂处理,LC3-Ⅱ 就不会被分解地蓄积下来,所以通过测定添加了溶酶体阻碍剂的样品与未添加的样品的LC3-Ⅱ量得到的差值可以被认为是因自噬被分解的LC3-Ⅱ量、即自噬通量。自噬通量是自噬活性的指标,该量值越大自噬活性就越高。p62 (SQSTM1/ sequestosome1)是和LC3有关的自噬相关蛋白,通过与LC3结合被自噬体选择性吸收分解,因此,细胞内的p62蛋白量变与自噬活性呈负相关。动态检测需通过自噬抑制剂实现,且不同抑制途径的效果可能存在差别。目前还没有能够适用于任何生物或实验背景的绝对标准来确定自噬状态,所以在观察自噬时应采取多层次、多角度的检测方法,尽可能使用短期和长期试验监测自噬反应,在细胞、蛋白和分子水平利用不同的技术和方法检测自噬。
2.3. 皮肤细胞自噬活性和皮肤老化的关系
衰老通常是指有机体从成年期开始功能逐步衰退的过程。皮肤是人体最大的器官也不能免于衰老的影响。除了固有的老化,由于皮肤持续暴露于外部刺激,短暂但重复的皮肤损伤可累积并导致皮肤的急性或慢性变化,如色素斑、皱纹和下垂、脱发,头发早白等。2023年Cell发表了最新版“衰老的标志”增加了巨自噬功能失调、慢性炎症和菌群失调三个标志。[13]越来越多的研究表明:(1)自噬功能随年龄增长而下降;(2)自噬是细胞稳态和机体寿命的关键决定因素;(3)自噬受损或失衡促进病理性的衰老和疾病。[14]
2020年花王的研究人员发现人类皮肤自噬活性随着年龄的增长而下降。局部比较结果表明:相对于健康皮肤,有老年色斑或与严重皮肤干燥相关的灰白色皮肤中自噬活性有明显下降。这表明自噬下降与人类皮肤过早老化有关(图2)[16]。通过mTORC1抑制恢复自噬可显著改善体外组织培养人皮肤的黑素体降解和表皮分化。这表明自噬通过控制黑素体降解和表皮分化的完整性,在维持多种皮肤状况(如均匀肤色和皮肤屏障功能)方面发挥着重要作用。[15]
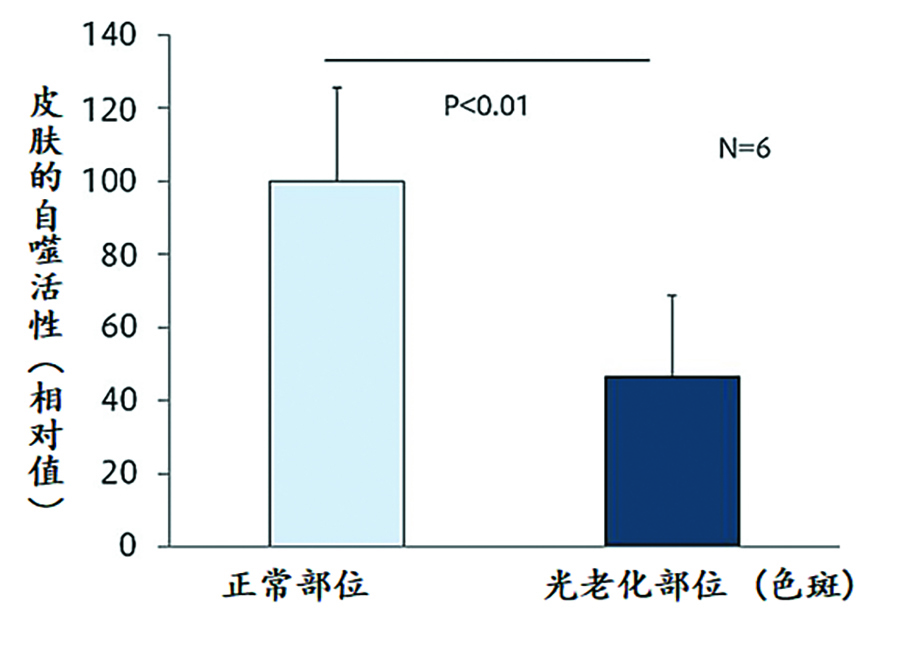
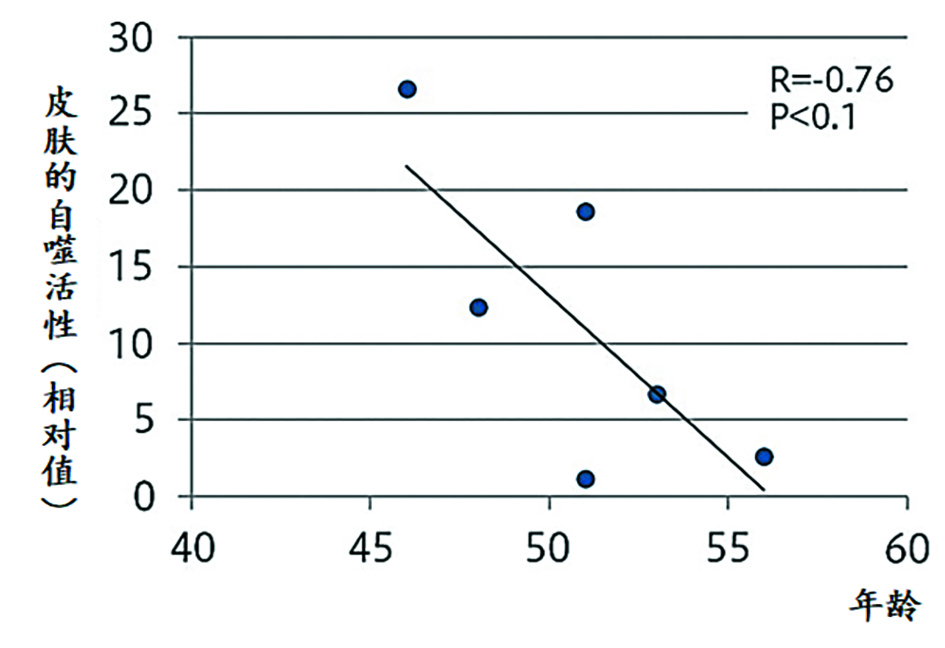
图2. [16]自噬下降与皮肤过早老化有关(上)
自噬活性随着年龄的增长而下降(下)
黑色素体是一种溶酶体相关细胞器, 产生于表皮黑素细胞,成熟后转移到角质形成细胞。2013年,花王的研究人员成功地测定了不同皮肤组织细胞中自噬通量,发现黑素体随后在角质形成细胞中可被自噬降解。实验结果表明,在皮肤组织培养中,自噬的诱导和抑制可分别显著地使皮肤变浅和变暗。自噬活性与皮肤色素沉着的程度有关,即与深色皮肤角质形成细胞相比,浅色皮肤角质形成细胞对黑素体降解能力更强。因此,自噬靶向黑素体降解被认为是一种高度保守的机制,表现为肤色的种族多样性。有趣的是自噬对角质形成细胞中的黑素体降解有显著作用,但对黑素细胞没有作用。[17]这可能与实验条件有关,但表明不同类型的皮肤细胞自噬依赖存在差异性以满足不同功能的需要。黑素细胞存在于表皮的基底层,其功能是分泌黑色素去保护角质形成细胞,自噬靶向黑素体降解发生在黑素细胞内可能不符合其功能,但并不意味黑素细胞的其它成分或细胞器不会成为自噬靶标。
皮肤老化是由不同类型的皮肤细胞的变化驱动的,可以根据寿命(与周转率成反比)和分化(在组织环境中执行特定功能)对这些细胞进行分类,在没有压力的情况下,快速更新的表皮上皮细胞如(短命)分化的角质形成细胞可以耐受对自噬的实验抑制。而长寿的皮肤细胞,如黑素细胞、触觉上皮细胞(瘙痒有关)和汗腺分泌细胞,则依赖于自噬来维持细胞稳态,并在衰老过程中正常执行其功能。在真皮中,间充质细胞的衰老和细胞外基质(ECM)的改变是衰老的标志。
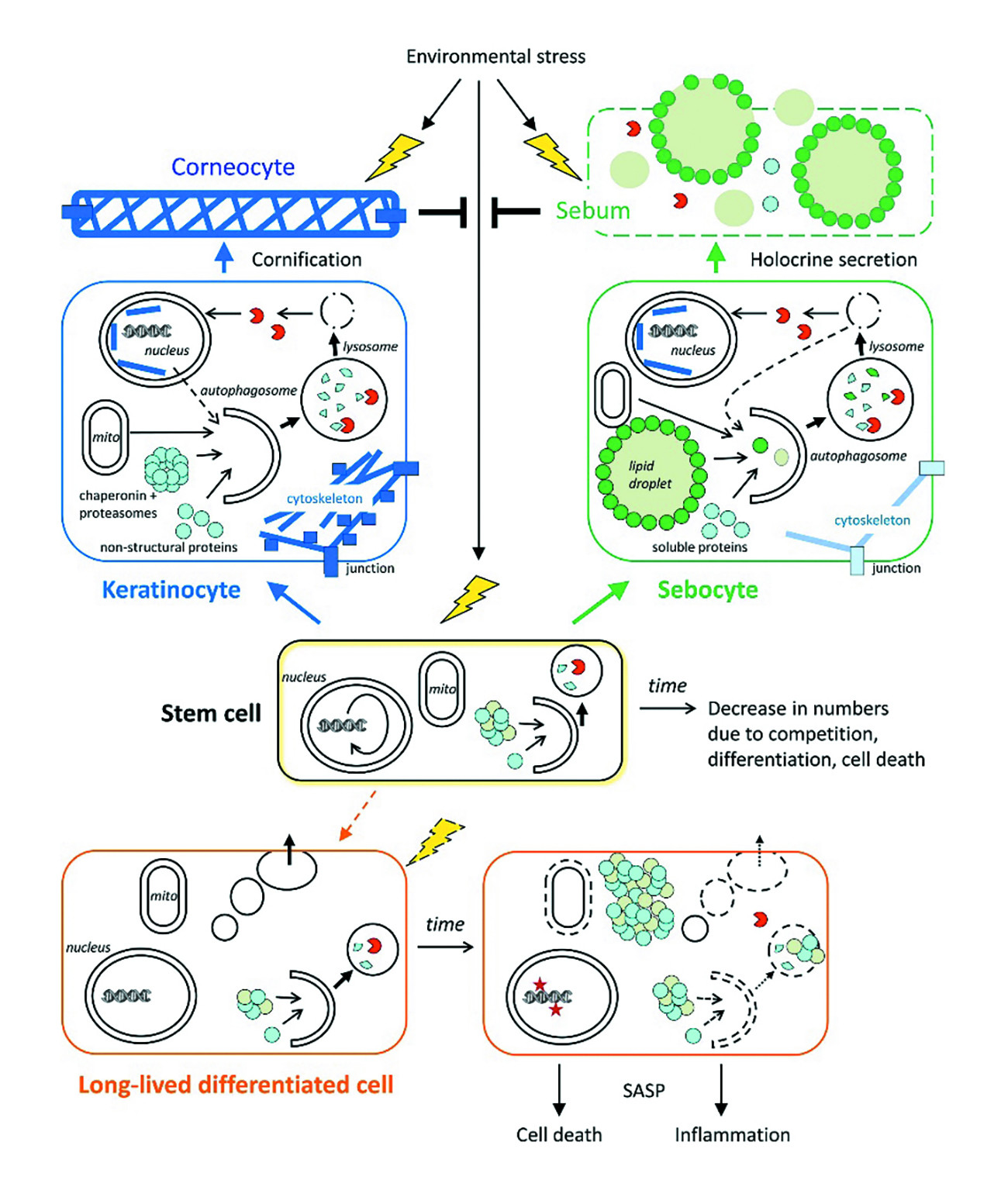
图3.自噬在皮肤细胞中的作用[18]
图3中示意性地显示了自噬对干细胞和长寿分化细胞(以汗腺分泌细胞为例)的角质化、全分泌和稳态的贡献。时间依赖性变化,如自噬能力下降,主要影响干细胞和长寿分化细胞。短命角质细胞和皮脂细胞由干细胞持续产生,然后迅速分化。自噬有助于角质细胞和皮脂的形成,保护皮肤的活细胞免受来自环境的压力因素的影响。干细胞转化为(短命)分化的角质形成细胞和皮脂细胞发生在整个生命中,而干细胞转化成长寿命分化的分泌细胞则很少发生在成年生命中。[18]
3.自噬循环原理在抗衰老化妆品领域的应用
由于生活医疗环境的差异,人口老龄化首先出现在经济发达国家或地区。日本社会从90年代初开始进入深度老龄化社会(65岁以上人口占比大于14%)。随着日本社会老龄化程度的加深,人们对抗老化产品的消费需求也促进了其抗老化研究的发展。因为自噬被认为是应激补救反应,人们期待通过自噬调控可以逆转衰老。
3.1. 自噬调控与抗衰老护肤
皮肤抗老化的焦点在肤色变化和皱纹与下垂。肤色是和皮肤色素有关,皱纹则与皮肤组织结构及成分有关。
肤色是皮肤抗老化研究的焦点之一。肤色和皮肤色素有关,已知影响肤色的色素有黑素细胞分泌的黑褐色素(Melanin) 、蛋白质非酶糖基化终产物(AGEs: Advanced glycation end products) 、由含有脂肪的残存物与溶酶体消化物所组成的脂褐素(Lipofuscin)等。传统美白产品研发主要关注的是减少黑色素生成、抑制黑色素小体转运、促进黑色素代谢。杜鹃醇白斑事件促使美白产品研发方向从阻断转向疏通,即促进黑色素的代谢。已知的黑色素代谢主要有2条途径:一是黑色素在皮肤内被分解、溶解和吸收后穿透基底膜,被真皮层的嗜黑色素细胞吞噬后,通过淋巴液带到淋巴结再经血液循环从肾脏排出体外;二是黑色素通过黑色素细胞树枝状突起,向角质形成细胞转移,然后随表皮细胞上行至角质层,随老化的角质细胞脱落而排出体外。[19, 20]
虽然发现了黑色素体可以在角质形成细胞中自噬降解, 但花王并未推出自噬调控概念的美白产品。黑色素随老化的角质细胞脱落而排出体外的代谢途径似乎更安全。2018年底POLA申请获批的使用医药部外品成分D-泛醇的美白机理,就是基于促进角质细胞代谢的。[21]
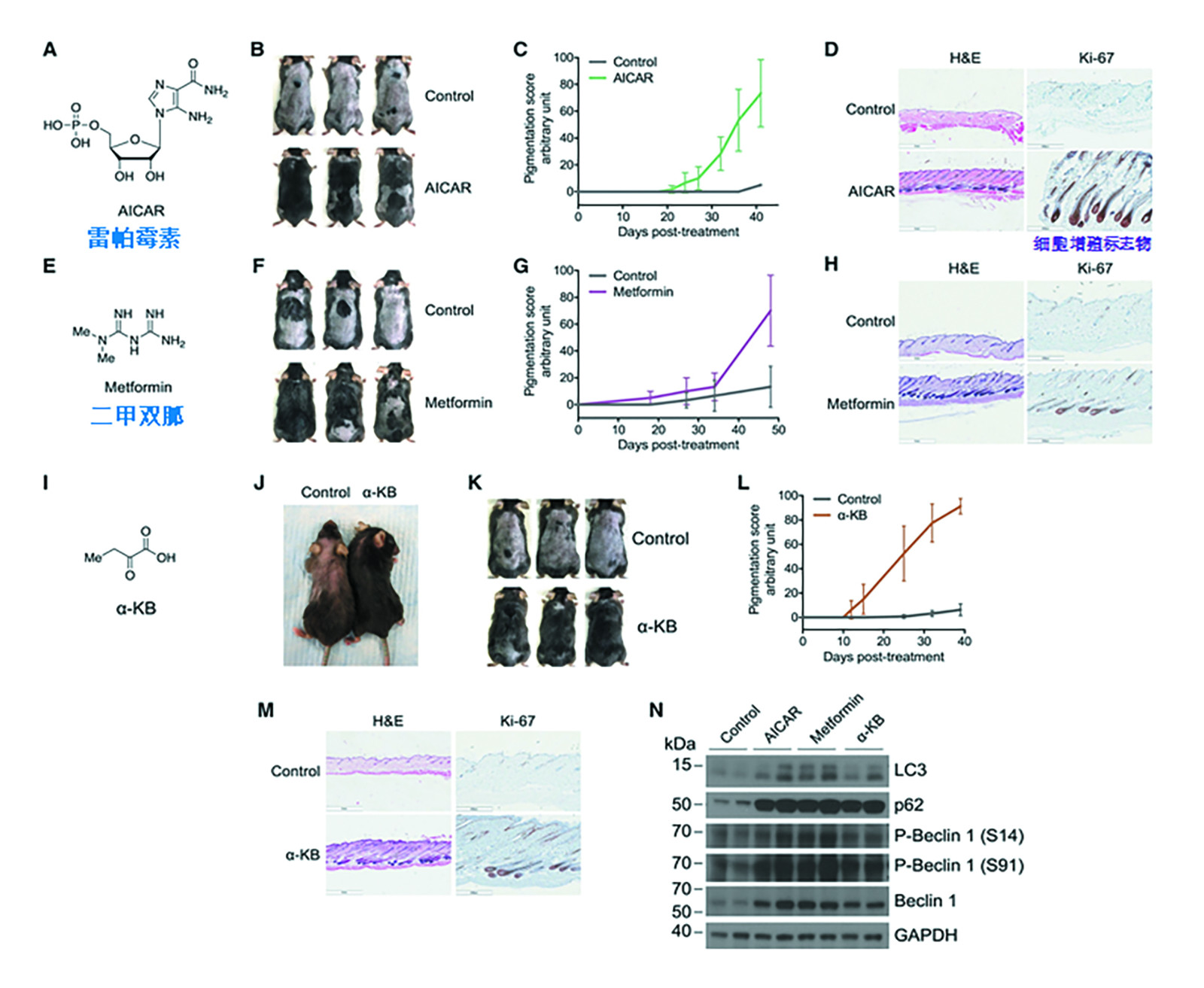
图4.雷帕霉素、二甲双胍和α-KB诱导毛发再生[36]
人类真皮的成纤维细胞是长寿细胞,因此容易积累内在和外在的损伤。POLA率先将自噬循环的概念导入到抗衰老化妆品中。研究对象是真皮纤维芽细胞,目的是活用自噬作用降解、消除和消化受损、变性、衰老和失去功能的细胞器及变性蛋白质等生物大分子,为细胞的生存和修复提供必要的能量。POLA的研究人员发现随年龄增长,真皮纤维芽细胞中自噬溶酶体的数量相对增加了,而溶酶体活性下降可能是自噬活性下降的原因之一。自噬活性下降和真皮组织成分变化和功能衰退有关,因此提出通过促进自噬循环实现皮肤细胞功能修复的途径。
自噬循环可通过检测柠檬酸循环(又称三羧酸循环)相关的辅酶NADH(烟酰胺腺嘌呤二核苷酸、Nicotinamide adenine dinucleotide)水平来确认,NADH水平提高意味着细胞代谢水平提高,可以通过弹性纤维、胶原蛋白、玻尿酸分泌量的增加来确认。[22]
虽然烟酰胺衍生物和细胞自噬的直接相关关系并不清楚,但诞生于2012年的自噬循环作为护肤理论之一仍然有实践意义。自噬是一个与溶酶有关的受控的细胞内代谢过程,如果溶酶不受控出现在细胞外结缔组织中会发生什么呢?
中性粒细胞是典型的吞噬细胞之一,是外周血循环和免疫系统中含量最丰富的白细胞,约占白细胞的60~70%,具有很强的趋化作用和吞噬功能。所谓趋化作用就是中性粒细胞会快速聚集到炎症部位,向细胞外释放颗粒内容物(类似溶酶体)。释出的酸性蛋白酶和中性蛋白酶,可以分解结缔组织的胶原蛋白、弹性蛋白等。
胶原蛋白、玻尿酸的流失及弹性蛋白受损都与皱纹产生有关。 POLA通过筛选发现:有效成分NEI-L1作为中性粒细胞蛋白酶MMP-1的抗体,可以抑制结缔组织弹性蛋白的降解从而实现改善皮肤皱文的效果。[23,24]也就是说,Pola推出的日本第一款医药部外品抗皱产品的研发着眼点同样是溶酶,只是自噬是细胞内的溶酶体作用,后者是考虑组织内免疫反应。
作为老化产物蛋白质非酶糖基化终产物(AGEs: Advanced glycation end products)和脂质过氧化最终产物Advanced Lipoxidation Endproducts(ALEs)同样影响肤色,[25]有研究表明外周巨噬细胞参与了从身体中移除AGEs的过程,[26] AGEs的蛋白部分可以被降解为糖基肽或糖基氨基酸,释放到血浆中后,可通过尿液排出。[27]
脂褐素(Lipofuscin)被认为是一种随着年纪增长或细胞操劳而增加的色素, 是不饱和脂肪酸氧化后的产物,也可能来自溶酶体的降解产物。血管中脂褐素的积累同样影响肤色,被作为美白靶标,通过移除血管中脂褐素可以改善肤色暗沉,提高透明感。[28]问题是脂褐素除胞吐之外,否存在脂褐素吞噬细胞可以选择性清除脂褐素?有研究表明脂褐素在人成纤维细胞中的积累会导致细胞在缺少氨基酸时自噬作用减弱,存活时间缩短。[29]
3.2.自噬活性与毛发生长
护肤产品研究焦点是美白和抗皱,而头皮护理所关注的则是防早白、防脱育发。
细胞对各种压力的反应途径包括,如营养感应和代谢调节、免疫反应和炎症、细胞周期和生长控制,以及细胞自噬和凋亡等程序。调控这些细胞过程的信号和调控自噬的信号之间存在紧密的整合。已发现许多经典的细胞凋亡信号通路与自噬的调控之间存在复杂错综的关联。[30]自噬对细胞凋亡的调控具有双重性:轻度的自噬在一定程度上保护细胞免受有害条件的影响,促进细胞的存活; 重度或快速的自噬则可能诱导细胞程序性死亡,称为自噬性细胞凋亡。
毛发生长是一个复杂的生理过程。从毛囊干细胞活化增殖、到有核细胞向无核、无细胞质的结构细胞的转变是毛发产生的关键。这种形式的细胞“死亡”或角质化,需要去除细胞器,使细胞质充满角质蛋白束,而角质蛋白束则需要进一步交联才能形成浓密的毛发。L.A. Jones等描述了这种形式的细胞“死亡”过程,其中包含细胞凋亡,自噬,线粒体自噬等方式。[31]相对于程序性“死亡”的细胞凋亡,自噬作为降解和回收细胞成分的基本过程,在毛发生长中的作用仍然存在争议;一方面,由于来自自噬相关基因7(ATG7)缺陷小鼠的皮肤移植表现出毛发生长异常,毛发生长可能需要自噬。[32]另一方面,心理压力可导致自噬和头发周期延迟。[33]
C. Parodi 等以人类头皮毛囊作为一个(微型)器官研究模型,观测了不同生长阶段毛母细胞的自噬活动及自噬活性。实验结果表明: 成长期毛母细胞的自噬较为活跃,衰退期自噬活性下降,激活毛囊细胞的自噬可以延长毛囊生长周期,自噬对于维持人类毛发的健康生长至关重要。[34]问题是自噬调控是否可以激活处于休止期的毛母细胞?
黄箐等[35, 36, 37]通过活体老鼠自噬调控(in vivo)实验,观察了休止期的老鼠经自噬诱导后毛发生长的情况。发现影响ATP三磷酸腺苷合成酶及mTOR信号回路的代谢产物α- KB等可以作为自噬诱导剂,通过激活自噬的方式激活休眠毛囊,并启动新的毛发生长周期。(图4)
头发再生需要激活休眠的毛囊干细胞,药物诱导的自噬足以激活静止的毛囊, 开启新的毛发生长周期。通过激活自噬,可以挽救因生长期缩短、休止期延长和/或生长期激活受阻而导致的脱发。器官培养头皮毛囊是一个很好的临床前研究模型,可用于开发评估以防脱育发为目标的自噬调节剂。
虽然自噬诱导剂很有可能是清除毛发成长障碍有效的药剂, 但支配着毛发生长周期的因子素很多,如角质形成细胞生长因子FGF7(别名KGF: keratinocyte growth factor)在成长期表达显著,可防御UV照射、化学疗法及毒物等导致的细胞死亡;而FGF5会诱导衰退期;生物钟基因 (Period1, BMAL1) 控制毛发周期,如果敲除Period1, BMAL1成长期就会显著变长[38],且KGF, BMAL1 与蛋白酶体、自噬两者的活化有关[39, 40]。人们对这些因素和自噬的关联性及自噬如何促进细胞和组织的长期健康的认识还非常有限。虽然已有把提升自噬的咖啡因[41, 42]作为药用化妆品 (cosmeceutical) 销售,并称可延长成长期、促进毛母细胞的增殖[43]。但现在可用于防脱育发的自噬诱导剂非常有限,相关研究还处于初级发展阶段。
3.3. 遗留问题与今后展望
近年来,越来越多的研究表明,自噬与皮肤老化及皮肤疾病密切相关。因此,自噬原理被越来越广泛地应用于抗衰老护肤产品的开发中。
据称一些天然成分,如咖啡因、绿茶多酚、大豆异黄酮等,可以通过调节自噬的过程,促进皮肤细胞的自我修复和更新,达到抗衰老的效果。细胞因子如EGF、FGF等可以促进细胞的自噬过程,从而促进皮肤细胞的修复和再生。一些抗老化妆品可以通过激活AMPK途径,促进自噬,从而达到抗衰老的效果。
“自噬受损”是正常衰老的一个核心特征。自噬和衰老之间的关系通常被描述为“减少自噬是有害的”和“增加自噬是有益的”,但这样的描述过于简单化。自噬只是免疫衰老调控网络中的一员,局限于溶酶体的胞内反应。自噬在不同组织细胞,不同生命周期所起的作用是不同的。如果增加自噬对恶性癌症细胞是有益的,则对人体健康就是有害的。
关于衰老过程中与自噬的关系还有许多问题需要解决。如对生命有益和有害的自噬阈值是什么?按照中国传统的阴阳哲学说法,自噬必须保持平衡,因为自噬的减少会导致有毒成分的积累,而过度的自噬可导致器官萎缩和其他有害影响。
相信随着人们对自噬这一个重要的细胞生理现象认知的不断加深,细胞层面的抗衰老梦想或许会实现。而自噬循环理论在抗衰老化妆品领域中的应用则是十分值得期待和实践的。
甘智斌 杨建中
参考文献:
【1】https://www.who.int/zh/news-room/fact-sheets/detail/ageing-and-health
【2】Hill, D., Cosgarea, I., Reynolds, N., Lovat, P., & Armstrong, J. (2021). Research Techniques Made Simple: Analysis of Autophagy in the Skin. The Journal of investigative dermatology, 141(1), 5–9.e1. https://doi.org/10.1016/j.jid.2020.10.004
【3】Schmalstieg, F. C., Jr, & Goldman, A. S. (2008). Ilya Ilich Metchnikoff (1845-1915) and Paul Ehrlich (1854-1915): the centennial of the 1908 Nobel Prize in Physiology or Medicine. Journal of medical biography, 16(2), 96–103. https://doi.org/10.1258 /jmb.2008.008006
【4】Klionsky D. J. (2008). Autophagy revisited: a conversation with Christian de Duve. Autophagy, 4(6), 740–743. https://doi.org/10.4161/auto.6398
【5】Takeshige, K., Baba, M., Tsuboi, S., Noda, T., & Ohsumi, Y. (1992). Autophagy in yeast demonstrated with proteinase-deficient mutants and conditions for its induction. The Journal of cell biology, 119(2), 301–311. https://doi.org/10.1083/jcb.119.2.301
【6】Thumm, M., Egner, R., Koch, B., Schlumpberger, M., Straub, M., Veenhuis, M., & Wolf, D. H. (1994). Isolation of autophagocytosis mutants of Saccharomyces cerevisiae. FEBS letters, 349(2), 275–280. https://doi.org/10.1016/0014-5793(94)00672-5
【7】Brokstad K. A. (2016). The 2016 Nobel Prize in Physiology or Medicine. Scandinavian journal of immunology, 84(6), 316. https://doi.org/10.1111/sji.12504
【8】Klionsky, D. J., Cueva, R., & Yaver, D. S. (1992). Aminopeptidase I of Saccharomyces cerevisiae is localized to the vacuole independent of the secretory pathway. The Journal of cell biology, 119(2), 287–299. https://doi.org/10.1083/jcb.119.2.287
【9】Tsukada, M., & Ohsumi, Y. (1993). Isolation and characterization of autophagy-defective mutants of Saccharomyces cerevisiae. FEBS letters, 333(1-2), 169–174. https://doi.org/10.1016/0014-5793(93)80398-e
【10】Pankiv, S., Clausen, T. H., Lamark, T., Brech, A., Bruun, J. A., Outzen, H., Øvervatn, A., Bjørkøy, G., & Johansen, T. (2007). p62/SQSTM1 binds directly to Atg8/LC3 to facilitate degradation of ubiquitinated protein aggregates by autophagy. The Journal of biological chemistry, 282(33), 24131–24145. https://doi.org/10.1074/jbc.M702824200
【11】Kirkin V. (2020). History of the Selective Autophagy Research: How Did It Begin and Where Does It Stand Today?. Journal of molecular biology, 432(1), 3–27. https://doi.org/10.1016/j.jmb.2019.05.010
【12】Klionsky, D. J., et al, (2021). Guidelines for the use and interpretation of assays for monitoring autophagy (4th edition)1. Autophagy, 17(1), 1–382. https://doi.org/10.1080/15548627.2020.1797280
【13】López-Otín, C., Blasco, M. A., Partridge, L., Serrano, M., & Kroemer, G. (2023). Hallmarks of aging: An expanding universe. Cell, 186(2), 243–278. https://doi.org/10.1016/j.cell.2022.11.001
【14】Aman, Y., Schmauck-Medina, T., Hansen, M., Morimoto, R. I., Simon, A. K., Bjedov, I., Palikaras, K., Simonsen, A., Johansen, T., Tavernarakis, N., Rubinsztein, D. C., Partridge, L., Kroemer, G., Labbadia, J., & Fang, E. F. (2021). Autophagy in healthy aging and disease. Nature aging, 1(8), 634–650. https://doi.org/10.1038/s43587-021-00098-4
【15】Murase, D., Kusaka-Kikushima, A., Hachiya, A., Fullenkamp, R., Stepp, A., Imai, A., Ueno, M., Kawabata, K., Takahashi, Y., Hase, T., Ohuchi, A., Nakamura, S., & Yoshimori, T. (2020). Autophagy Declines with Premature Skin Aging resulting in Dynamic Alterations in Skin Pigmentation and Epidermal Differentiation. International journal of molecular sciences, 21(16), 5708. https://doi.org/10.3390/ijms21165708
【16】https://www.kao.com/jp/corporate/news/rd/2019/20191118-001/
【17】Murase, D., Hachiya, A., Takano, K., Hicks, R., Visscher, M. O., Kitahara, T., Hase, T., Takema, Y., & Yoshimori, T. (2013). Autophagy has a significant role in determining skin color by regulating melanosome degradation in keratinocytes. The Journal of investigative
dermatology, 133(10), 2416–2424. https://doi.org/10.1038/jid.2013.165
【18】Eckhart, L., Tschachler, E., & Gruber, F. (2019). Autophagic Control of Skin Aging. Frontiers in cell and developmental biology, 7, 143. https://doi.org/10.3389/fcell.2019.00143
【19】Park, S. Y., Jin, M. L., Kim, Y. H., Kim, Y., & Lee, S. J. (2011). Aromatic-turmerone inhibits α-MSH and IBMX-induced melanogenesis by inactivating CREB and MITF signaling pathways. Archives of dermatological research, 303(10), 737–744. https://doi.org/10.1007/s00403-011-1155-7
【20】Lee, W. J., Rhee, doY., Bang, S. H., Kim, S. Y., Won, C. H., Lee, M. W., Choi, J. H., & Chang, S. E. (2015). The natural yeast extract isolated by ethanol precipitation inhibits melanin synthesis by modulating tyrosinase activity and downregulating melanosome transfer. Bioscience, biotechnology, and biochemistry, 79(9), 1504–1511. https://doi.org/10.1080/09168451.2015.1032880
【21】http://www.pola-rm.co.jp/pdf/release_20181220.pdf
【22】http://www.pola-rm.co.jp/pdf/release_20130624_1.pdf
【23】http://www.pola-rm.co.jp/pdf/release_20160714.pdf
【24】http://www.pola-rm.co.jp/pdf/release_20191008_1.pdf
【25】https://corp.shiseido.com/jp/releimg/1808-j.pdf
【26】Miyata, T., Ueda, Y., Horie, K., Nangaku, M., Tanaka, S., van Ypersele de Strihou, C., & Kurokawa, K. (1998). Renal catabolism of advanced glycation end products: the fate of pentosidine. Kidney international, 53(2), 416–422. https://doi.org/10.1046/j.1523-1755.1998.00756.x
【27】Gugliucci, A., Mehlhaff, K., Kinugasa, E., Ogata, H., Hermo, R., Schulze, J., & Kimura, S. (2007). Paraoxonase-1 concentrations in endstage renal disease patients increase after hemodialysis: correlation with low molecular AGE adduct clearance. Clinica chimica acta; international journal of clinical chemistry, 377(1-2), 213–220. https://doi.org/10.1016/j.cca.2006.09.028
【28】http://www.pola-rm.co.jp/pdf/release_20201203_02.pdf
【29】Terman, A., Dalen, H., & Brunk, U. T. (1999). Ceroid/lipofuscin-loaded human fibroblasts show decreased survival time and diminished autophagocytosis during amino acid starvation. Experimental gerontology, 34(8),943–957. https://doi.org/10.1016/s0531-5565(99)00070-4
【30】Maiuri, M. C., Zalckvar, E., Kimchi, A., & Kroemer, G. (2007). Self-eating and self-killing: crosstalk between autophagy and apoptosis. Nature reviews. Molecular cell biology, 8(9), 741–752. https://doi.org/10.1038/nrm2239
【31】Jones, L. A., Harland, D. P., Jarrold, B. B., Connolly, J. E., & Davis, M. G. (2018). The walking dead: sequentialnuclear and organelle destruction during hair development. The British journal of dermatology, 178(6),1341–1352. https://doi.org/10.1111/bjd.16148
【32】Rossiter, H., Stübiger, G., Gröger, M., König, U., Gruber, F., Sukseree, S., Mlitz, V., Buchberger, M., Oskolkova, O.,Bochkov, V., Eckhart, L., & Tschachler, E. (2018). Inactivation of autophagy leads to changes in sebaceous glandmorphology and function. Experimental dermatology, 27(10), 1142–1151. https://doi.org/10.1111/exd.13752
【33】Wang, L., Guo, L. L., Wang, L. H., Zhang, G. X., Shang, J., Murao, K., Chen, D. F., Fan, X. H., & Fu, W.Q. (2015). Oxidative stress and substance P mediate psychological stress-induced autophagy and delay ofhair growth in mice. Archives of dermatological research, 307(2), 171–181.https://doi.org/10.1007/s00403-014-1521-3
【34】Parodi, C., Hardman, J. A., Allavena, G., Marotta, R., Catelani, T., Bertolini, M., Paus, R., & Grimaldi, B. (2018).
Autophagy is essential for maintaining the growth of a human (mini-)organ: Evidence from scalp hair follicleorgan culture. PLoS biology, 16(3), e2002864. https://doi.org/10.1371/journal.pbio.2002864
【35】Fu, X., Chin, … Huang, J. (2015). 2-Hydroxyglutarate Inhibits ATP Synthase and mTOR Signaling. Cell metabolism, 22(3),508–15.https://doi.org/10.1016/j.cmet.2015.06.009
【36】Chai, M., Jiang, M., Vergnes, L., Fu, X., de Barros, S. C., Doan, N. B., Huang, W., Chu, J., Jiao, J., Herschman, H., Crooks, G. M., Reue, K., & Huang, J. (2019). Stimulation of Hair Growth by Small Molecules that Activate Autophagy. Cell reports, 27(12), 3413–3421.e3. https://doi.org/10.1016/j.celrep.2019.05.070
【37】J. Huang, et al. “Ketobutyrate compounds and compositions for treating age-related symptoms anddiseases”. WO2016003854A1
【38】Al-Nuaimi, Y., Hardman, J. A., Bíró, T., Haslam, I. S., Philpott, M. P., Tóth, B. I., Farjo, N., Farjo, B., Baier, G., Watson, R. E. B., Grimaldi, B., Kloepper, J. E., & Paus, R. (2014). A meeting of two chronobiological systems: circadian proteins Period1 and BMAL1 modulate the human hair cycle clock. The Journal of investigative dermatology, 134(3), 610–619. https://doi.org/10.1038/jid.2013.366
【39】Huang, G., Zhang, F., Ye, Q., & Wang, H. (2016). The circadian clock regulates autophagy directly through thenuclear hormone receptor Nr1d1/Rev-erbα and indirectly via Cebpb/(C/ebpβ) in zebrafish. Autophagy, 12(8), 1292–1309.https://doi.org/10.1080/15548627.2016.1183843
【40】Jeong, K., He, B., Nohara, K., Park, N., Shin, Y., Kim, S., Shimomura, K., Koike, N., Yoo, S. H., & Chen, Z. (2015).Dual attenuation of proteasomal and autophagic BMAL1 degradation in Clock Δ19/+ mice contributes to improvedglucose homeostasis. Scientific reports, 5, 12801. https://doi.org/10.1038/srep12801
【41】Sinha, R. A., Farah, B. L., Singh, B. K., Siddique, M. M., Li, Y., Wu, Y., Ilkayeva, O. R., Gooding, J., Ching, J., Zhou,J., Martinez, L., Xie, S., Bay, B. H., Summers, S. A., Newgard, C. B., & Yen, P. M. (2014). Caffeine stimulates hepatic lipidmetabolism by the autophagy-lysosomal pathway in mice. Hepatology (Baltimore, Md.), 59(4), 1366–1380.https://doi.org/10.1002/hep.26667
【42】Mathew, T. S., Ferris, R. K., Downs, R. M., Kinsey, S. T., & Baumgarner, B. L. (2014). Caffeine promotes autophagy in skeletal muscle cells by increasing the calciumdependent activation of AMP-activated protein kinase. Biochemical and biophysical research communications,4 5 3 ( 3 ) , 411–418.https://doi.org /10.1016 /j.bbrc.2014.09.094
【43】Fischer, T. W., Herczeg-Lisztes, E., Funk, W., Zillikens, D., Bíró, T., & Paus, R. (2014). Differential effects of caffeine on hair shaft elongation, matrix and outer root sheath keratinocyte proliferation, and transforming growth factor-β2/insulin-like growth factor-1-mediated regulation of the hair cycle in male and female human hair follicles in vitro. The British journal of dermatology, 171(5), 1031–1043. https://doi.org/10.1111/bjd.13114
来源:荣格-《国际个人护理品生产商情》
原创声明:
本站所有原创内容未经允许,禁止任何网站、微信公众号等平台等机构转载、摘抄,否则荣格工业传媒保留追责权利。任何此前未经允许,已经转载本站原创文章的平台,请立即删除相关文章。