荣格工业资源APP
了解工业圈,从荣格工业资源APP开始。
背景:表面活性剂广泛应用于护肤品和洁面产品中,但也可能引起身体不适。本研究利用体内拉曼光谱探究表面活性剂对皮肤的刺激机制,这在文献中尚未报道。
方法:选用十二烷基硫酸钠(SDS)作为表面活性剂代表。通过拉曼光谱技术和皮肤放大镜对6名志愿者皮肤的两种状态(无SDS和接触SDS)进行了SDS负面效果的研究。
结论:从皮肤放大镜拍摄的照片中可以看到SDS对正常皮肤表面的损伤,这种表面损伤与拉曼光谱分析的皮下损伤相吻合。与正常皮肤相比,损伤皮肤在2~12 μm的细胞间脂质(ICL)横向堆积序列明显减少(P < 0.05),超过12 μm的皮肤深度以下未检出。由于SDS的强烈干扰,0~2 μm的皮肤深度无法测定。角蛋白的二级和三级结构没有明显变化。
关键词:体内;拉曼光谱;刺激机制;表面活性剂
介绍
角质层(SC)作为皮肤的最外层,其作用主要体现在抵抗外界刺激和防止皮肤成分流失。角质层的结构可以看作“砖和泥浆”。角化细胞构成“砖”,其主要成分是束状角蛋白。细胞间脂质(ICL)构成了“泥浆”,包括神经酰胺、脂肪酸和胆固醇。角质层中的细胞间脂质呈六角形或正交排列,这与透皮失水(TEWL)密切相关1。角化细胞和细胞间脂质在皮肤的物理屏障功能中起关键作用。如果它们受到影响或损坏,皮肤的屏障功能将直接受到影响2。
表面活性剂由于具有降低界面张力、乳化、除污等功能,在护肤品和洁面产品中得到广泛的应用。在清洁产品中,它们的质量比可达10%-15%。表面活性剂使用不当会导致皮肤损伤,引起一系列皮肤不适症状,如肿胀、刺激、干燥、粗糙、瘙痒、红斑,或诱发皮肤敏感2-9。
表面活性剂按极性基团的电荷可分为阴离子表面活性剂、阳离子表面活性剂、非离子表面活性剂和两性表面活性剂。十二烷基硫酸钠(SDS)是阴离子表面活性剂的代表,常被用于评价表面活性剂的刺激作用或在贴片试验中作为阳性对照。研究表明十二烷基硫酸钠对皮肤屏障的负面作用是由于它可以摄取脂质,改变脂质的组成和排列顺序,从而引起脂质的紊乱。十二烷基硫酸钠对角蛋白的破坏作用主要表现在与角蛋白结合并引起其变性3-7。由于其分子量小,结构简单,十二烷基硫酸钠可以轻易渗透角质层到达组织层,从而增强细胞的氧化应激,诱导自由基的产生8,增加IL-1α等促炎因子的分泌,导致皮肤炎症反应的发生。研究还表明,与皮肤持水能力呈负相关的羰基化角蛋白水平的增加,这可能是十二烷基硫酸钠进入活性表皮细胞后皮肤失水的原因之一。此外,十二烷基硫酸钠可导致神经C纤维末梢的生长延伸,引起神经生长因子分布不均,使皮肤对外界刺激更加敏感8。
体外和体内研究是研究表面活性剂引起皮肤损伤的主要途径。在体外,采用牛血清白蛋白(BSA1)和猪耳皮肤模型5,7,用X-射线或红外光谱法研究十二烷基硫酸钠对角蛋白和脂质的影响。
通过对鸡胚绒毛尿囊膜和红细胞的体外实验,评价十二烷基硫酸钠对细胞膜的破坏作用10,11。体外拉曼实验表明,表面活性剂能破坏细胞间脂质的横向排列序列,但对角蛋白的α-螺旋结构影响不大12。十二烷基硫酸钠对人体皮肤含水量和透皮失水的影响一般采用常规仪器进行研究3,13,14。
然而,目前还没有文献报道关于在体内、实时和非创伤性的研究表面活性剂对人体皮肤的结构或生理功能产生负面影响或破坏,这一点尤为引人关注。
本研究选择十二烷基硫酸钠(SDS)作为表面活性剂的代表;建立SDS对人体皮肤的刺激模型;并对SDS对人的刺激机制进行了研究,通过拉曼光谱技术,结合SDS对皮肤损伤程度的视觉图片,对角质层结构进行实时、非创伤性的逐层扫描。这些研究可望为了解表面活性剂对皮肤的刺激作用及其保护作用提供更多的信息。
材料和方法
2.1 材料
十二烷基硫酸钠(简称SDS,超纯级,德国达姆施塔特默克集团),国际标准芬恩腔贴片(德国汉堡艾伯林博士股份有限公司)。
2.2 志愿者
根据纳入和排除标准,6名志愿者(2名男性,4名女性)年龄从20岁到30岁(平均26岁)。志愿者们被要求在实验前至少72小时不要在前臂使用任何护肤品,并且至少4小时不要洗澡或淋浴。实验期间室温为25±1℃,湿度为45±2%。适应20分钟后,将30μL的2% 十二烷基硫酸钠溶液滴到单独的贴片室上,在6名志愿者的前臂试验部位敷贴3小时。然后移除贴片,等待20分钟后再收集数据。拍摄同一部位皮肤在使用十二烷基硫酸钠贴片前后的两种状态,并在每位志愿者的平均时间内采集两种皮肤状态的拉曼光谱。
2.3 仪器
采用激光波长为660 nm的共聚焦拉曼显微镜(Horiba Jobin Yvon,Villeneuved'ascq,法国)。通过边缘滤波器对信号进行滤波,横向分辨率为4 cm−1,光栅宽度为1200槽/mm。在同一测试点上平行采集至少5次皮肤深度范围为0-12 μm的拉曼光谱。在高波数区(2600-3800 cm−1)每个光谱的采集时间为2秒,在指纹区(400-2000 cm−1)为4秒。通过多项式函数减去荧光背景。光谱数据用LabSpec 6.0软件(Horiba Scientific,里尔,法国)处理。在获得拉曼光谱之前,使用Visioscan VC98(Courage + khazaka电子股份有限公司,科隆,德国)拍摄皮肤表面照片。
2.4 十二烷基硫酸钠(SDS)的相对渗透性分析
获得了十二烷基硫酸钠、正常皮肤和十二烷基硫酸钠处理皮肤的三组拉曼光谱。根据公式,CSDS处理皮肤=αC皮肤+βCSDS,其中α和β分别是皮肤和十二烷基硫酸钠的系数15。用最小二乘法拟合曲线并计算系数。β/α代表十二烷基硫酸钠在皮肤中的相对渗透量。
2.5 细胞间脂质 (ICL) 横向堆积序列分析
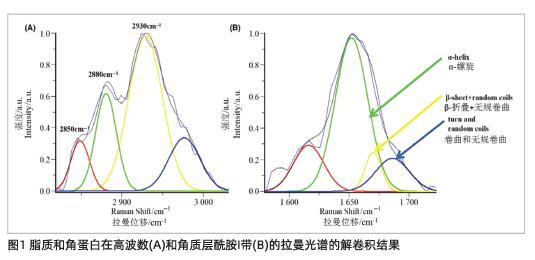
细胞间脂质横向堆积序列的特征是2880 cm-1到2850 cm-1的峰高比,其中2880 cm-1和2850 cm-1分别代表CH2对称和反对称拉伸振动(图1A16)。使用基于高斯函数的反卷积方法可减少2930 cm-1处角蛋白CH3拉伸振动的干扰(图1A)17。
2.6 角蛋白结构分析
与角蛋白二级结构相关的酰胺I带(1580-1720 cm-1)可分为四个高斯峰(图1B),其中1617 cm-1是色氨酸、酪氨酸和苯丙氨酸的特征峰;1650 cm-1表示α-螺旋;1669 cm-1表示β-折叠和无规卷曲;1686 cm-1分别表示蛋白质中的卷曲和无规卷曲17,18。角蛋白二级结构是否受到十二烷基硫酸钠干预的影响,其特征在于AUC(β-折叠+转角和无规卷曲)与AUC(α-螺旋)的比值,其反映了角蛋白中α-螺旋与β-折叠变化的相对量。十二烷基硫酸钠对角蛋白三级结构的影响以角蛋白在2930 cm-1处CH3拉伸振动的位置为特征(图1A),它代表角蛋白的折叠和展开状态。2930 cm-1的位置对CH3侧链的暴露状态敏感,这对应于角蛋白展开(较高位置)和折叠状态(较低位置)18,19。
2.7 统计分析
利用R 3.5.3,MATLAB 2014a,Origin Pro8和Microsoft Excel的统计函数进行统计分析。采用主成分分析(PCA)去除指纹区域的噪声。这是通过使用前四个主成分重建拉曼光谱来实现的。为了证实正常皮肤和经十二烷基硫酸钠(SDS)处理的皮肤的平均值之间存在显著的统计学差异,采用配对样本t检验。
结果
3.1 皮肤表面的拍摄结果
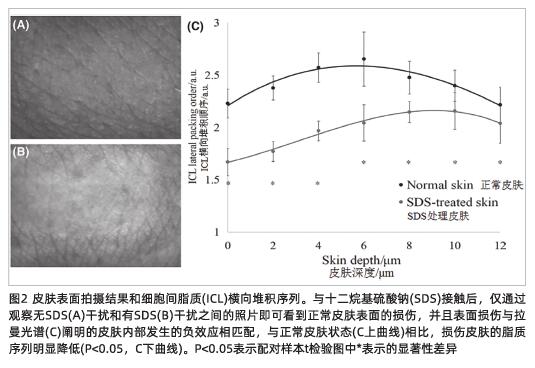
皮肤的表面照片显示出,与正常皮肤(如图2B所示)相比,使用十二烷基硫酸钠(SDS) 3小时(如图2A所示)后,皮肤的纹理受到了破坏。
3.2 十二烷基硫酸钠(SDS)的相对渗透
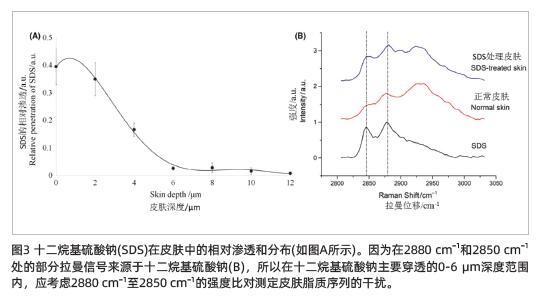
在皮肤深度为0-2 μm时,十二烷基硫酸钠的渗透率最高,并在2-6 μm范围内迅速下降,仅少量的十二烷基硫酸钠渗透到6 μm以下的皮肤中(图3A)。
3.3 十二烷基硫酸钠(SDS)对细胞间脂质(ICL)横向堆积序列的影响
使用2880 cm-1至2850 cm-1波数处的峰高比,来描述位于同一测试部位的正常皮肤与使用了十二烷基硫酸钠处理的皮肤(图2C),在0-12 μm(P<0.05)皮肤深度范围内细胞间脂质横向堆积序列显著下降。应该指出的是,在分析经过十二烷基硫酸钠处理的皮肤细胞间脂质横向堆积序列时,在得出结论前,应考虑源于十二烷基硫酸钠的2880 cm−1-2850 cm−1波数处拉曼信号的干扰(图3B),特别是在0-6 μm的皮肤深度处(图3A)。结合十二烷基硫酸钠的渗透性,在讨论部分将详细分析十二烷基硫酸钠对细胞间脂质横向堆积序列的影响。
3.4 十二烷基硫酸钠(SDS)对角蛋白结构的影响
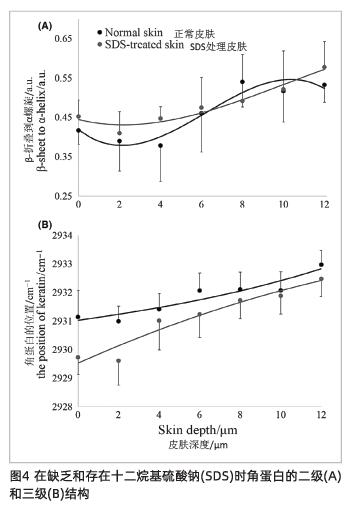
十二烷基硫酸钠对皮肤角蛋白二级结构的影响,其特征是β-折叠与α-螺旋比值的变化。图4A中的数据表明,该比率呈上升趋势,但在皮肤深度0-12 μm(P>0.05)时无显著性差异。通过观察CH3峰位的变化,在0-4 μm(P<0.1)的皮肤深度处,使用十二烷基硫酸钠会影响角蛋白的三级结构,这代表了角蛋白的折叠和展开状态的变化(图4B)。
讨论
众所周知,表面活性剂可能对皮肤产生负面影响。在本研究中,用皮肤表面图片观察十二烷基硫酸钠(SDS)引起的皮肤损伤。此外,从皮肤损伤的外观来看,拉曼光谱被用于研究十二烷基硫酸钠对体内损伤皮肤下的内部结构或物质基础的实时和非创伤性的影响。考虑到文献报道的十二烷基硫酸钠穿透深度,皮肤深度选择为0~12 μm(未检测到超过12 μm的深度)。
4.1 细胞间脂质(ICL)横向堆积序列
4.1.1 细胞间脂质(ICL)横向堆积序列的数据处理方法
为了避免角蛋白在2880 cm-1处拉曼信号的干扰,本研究采用基于高斯函数的反卷积方法,在2820 cm-1至3030 cm-1范围内计算2880 cm-1至2850 cm-1处的峰值强度比,结果介于2和3之间。在文献中的一些体内研究中19,21,细胞间脂质横向堆积序列是用光谱上2880 cm-1到2850 cm-1的强度比直接计算的,没有进行反卷积就得到了类似的结果。在体外皮肤模型上报告了1-1.5的比率18。这是因为在离体皮肤模型上使用热处理和胰蛋白酶解离角质层,这可能会影响细胞间脂质的横向堆积顺序,导致位于2850 cm-1处的峰值强度增加和比率降低22。Choe CS使用该算法消除2880 cm-1和2850 cm-1处角蛋白的影响,比值在0.6和1.8之间20,小于2比3。这可能是由于不同的数据处理方法。在本研究中,通过2820 cm-1和3030 cm-1的连接进行背景减除,以避免水的拉曼信号的影响,但可能会丢失一部分脂质信号,这导致2880 cm-1到2850 cm-1的计算值较高,但总体变化趋势与文献一致20。
4.1.2 十二烷基硫酸钠(SDS)对细胞间脂质(ICL)横向堆积序列的影响
如图2C所示,在没有十二烷基硫酸钠的正常皮肤中,细胞间脂质横向堆积序列在皮肤深处的4-8 μm是最高的(约为角质层厚度的20%-40%),这与文献中的报告一致20。
如第3节所述,对于经过十二烷基硫酸钠处理的皮肤,当十二烷基硫酸钠以相对较高的水平穿透皮肤时,其拉曼信号会干扰细胞间脂质横向堆积序列的计算,因此有必要先测量和计算穿透皮肤的十二烷基硫酸钠的含量。在这项研究中,使用十二烷基硫酸钠对细胞间脂质横向堆积序列的分析分为三个部分:首先,在0-2 μm的皮肤深度处,十二烷基硫酸钠具有最高的渗透率(图3A),因此,2880 cm-1至2850 cm-1比率的变化主要由于十二烷基硫酸钠和皮肤的光谱引起的(图3B),并且由于十二烷基硫酸钠的强干扰,无法正确计算十二烷基硫酸钠对皮肤细胞间脂质横向堆积序列的影响;其次,从2 μm到6 μm,十二烷基硫酸钠渗透率的迅速降低(图3A),皮肤层中2880 cm-1至2850 cm-1的比率差异在使用十二烷基硫酸钠后没有显著变化(图2C,灰色曲线),未使用十二烷基硫酸钠的皮肤(图2C,黑色曲线)在2880 cm-1至2850 cm-1的比率相比使用十二烷基硫酸钠处理的皮肤(图2C,灰色曲线)显著降低。因此可以推断,这种比率的急剧下降主要是由皮肤细胞间脂质横向堆积序列的变化造成的,并且十二烷基硫酸钠干扰的可能性非常低。换句话说,细胞间脂质横向堆积序列被认为是由于十二烷基硫酸钠在2-6 μm皮肤深度的刺激而降低的。最后,在6-12 μm,十二烷基硫酸钠的渗透率非常低(图3A),这意味着十二烷基硫酸钠对2880 cm-1至2850 cm-1的比率的影响最小,因此该深度范围内的比率可以主要反映细胞质脂质横向堆积序列的变化。这些结果表明,十二烷基硫酸钠显著降低了6-12 μm处的皮肤脂质序列(图2C)。
据报道,细胞间脂质的横向堆积序列与脂质构象有关。当细胞间脂质的横向堆积序列降低时,脂簇构象增加,脂质分子之间的细胞间空间扩大20,这增加了十二烷基硫酸钠渗入组织层的风险。在这项研究中,十二烷基硫酸钠水溶液的浓度为2%,高于十二烷基硫酸钠的临界胶束浓度(在25°C时约0.0286%),此时十二烷基硫酸钠的单体会聚集成胶束。形成的胶束具有提取脂质(主要是脂肪酸)和胆固醇的功能,这将导致细胞间脂质横向堆积序列的降低。另一方面,残留在皮肤中的十二烷基硫酸钠可能分解为单体结构并进一步渗透。由于十二烷基硫酸钠的脂肪酸链与脂质疏水末端的碳链具有相似的结构4,因此十二烷基硫酸钠单体对屏障功能的破坏是通过单体结构和细胞间脂质中的长层状结构的结合来实现的,主要是长链脂质23,例如神经酰胺;在这种情况下,脂质的提取是无关紧要的1,3。十二烷基硫酸钠单体可以减少内源性脂质中的正交型脂质(2880 cm-1) 并增加六边型脂质(2850 cm-1),增加脂质流动性24,并改变脂质分子的序列。此外,S.Kikuchi发现前臂皮肤的脂质序列高于脸颊皮肤的脂质序列,这表明十二烷基硫酸钠可能对脸颊皮肤有更大的影响2。
4.2 角蛋白的结构
4.2.1 十二烷基硫酸钠(SDS) 对角蛋白二级结构的影响
角蛋白是角质层的主要成分,约占其干重的60%。25二级结构中的α-螺旋是维持角质层正常生理功能的重要结构。单体十二烷基硫酸钠可能破坏角蛋白的α-螺旋结构26,导致角蛋白从折叠状态变为展开状态,暴露更多的原来被隐藏的角蛋白结合位点和疏水位置。表面活性剂将与水争夺上述结合位点或位置,导致皮肤刺激、粗糙和红斑2,4,7。玉米醇溶蛋白(Zein)和牛血清白蛋白(BSA)的模型实验表明,表面活性剂亲水端离子,特别是离子表面活性剂,能与蛋白质的离子基团发生静电作用,引起蛋白质变性。
此外,玉米醇溶蛋白27和牛血清白3蛋白的模型实验表明,表面活性剂特别是离子型表面活性剂中亲水端的离子与蛋白质的离子基团发生静电相互作用,导致蛋白质变性。然而,这种效应主要是由表面活性剂的单体引起的28,在本研究中,β-折叠与α-螺旋的比值代表角蛋白螺旋结构的比例。比例越大,角蛋白的α-螺旋结构越少,越不利于皮肤屏障。我们的结果(图4A)显示,该比例在十二烷基硫酸钠刺激前后没有显著变化,这与文献中的报告一致12。这可能是因为所用的2%浓度的十二烷基硫酸钠已经超过了临界胶束浓度,十二烷基硫酸钠在溶液中主要以胶束的形式存在,导致角蛋白的二级结构没有明显变化。在随后的实验中,可以通过降低十二烷基硫酸钠的浓度来研究十二烷基硫酸钠对蛋白质的负面影响。
4.2.2 十二烷基硫酸钠(SDS)对角蛋白三级结构的影响
随着角蛋白CH3峰的位置从2930 cm-1移到较低的波数时,表明折叠状态的结构增加17。结果表明CH3峰的位置显示仅在0-4 μm的深度(图4b)处移动到下波数(图4b),这可能是由于在2930 cm-1处的十二烷基硫酸钠的拉曼激光信号的干扰。换句话说,我们的模型中2%的十二烷基硫酸钠对角蛋白三级结构的影响并不显著。
当角蛋白在2930 cm-1处的CH3峰位置向较低波数移动时,表明折叠状态的结构增加。结果表明,CH3峰的位置仅在0~4 μm深度处移动到低波数(P<.1)(图4B),这可能是在2930 cm-1处十二烷基硫酸钠的拉曼信号的干扰所致。换言之,2%的十二烷基硫酸钠对角蛋白的三级结构影响不显著。
5 结论
采用视觉和“皮肤内窥”技术,对十二烷基硫酸钠(SDS)刺激人体皮肤的机制进行了实时、非创伤性研究。利用拉曼光谱对十二烷基硫酸钠刺激皮肤的角质层结构进行逐层扫描,实现了“皮肤内窥”。结果表明,皮肤表面的可见损伤与皮肤内脂质屏障的损伤是一致的。细胞间脂质(ICL)在2~12 μm深度的横向堆积序列明显降低。我们的结果与文献中的体外研究一致24。据我们所知,在十二烷基硫酸钠主要穿透的0-2 μm深度范围内,由于十二烷基硫酸钠产生的部分拉曼光谱特征会干扰皮肤脂质序列的计算,因此无法检测出皮肤脂质序列。角蛋白结构没有明显改变,这与文献报道一致12。
综上所述,利用拉曼光谱研究了十二烷基硫酸钠对人体皮肤实时刺激的机理,即十二烷基硫酸钠能降低皮肤角质层脂质的有序性,从而削弱皮肤屏障功能。我们的结果加强了文献中的体外研究。本研究中,视觉损伤的结果与内在机制相互支持,有望为表面活性剂的皮肤刺激及其预防、拮抗作用,以及外用产品表面活性剂刺激的的恢复提供理论依据。
参考文献:
Hoppel M, Kwizda K, Baurecht D, Caneri M, Valenta C. The effect of a damaged skin barrier on percutaneous absorption of SDS and skin hydration investigated by confocal Raman spectroscopy. Exp Dermatol. 2016;25:390-392.
2.Kikuchi S, Aosaki T, Bito K, Naito S, Katayama Y. In vivo evaluation of lateral lipid chain packing in human stratum corneum. Skin Res Technol. 2014;21:76-83.
3.Mukherjee S, Yang L, Vincent C, Lei X, Ottaviani MF, Ananthapadmanabhan KP. A comparison between interactions of triglyceride oil and mineral oil with proteins and their ability to reduce cleanser surfactant-induced irritation. Int J Cosmetic Sci. 2015;37: 371-378.
4.Purohit P, Chandar P, Vilinska A, Ananthapadmanabhan KP, Somasundaran P. Effect of mixed surfactants on stratum corneum: a drying stress and Raman spectroscopystudy.Int J CosmeticSci.2014;36: 379-385.
5.Froebe CL, Simion FA, Rhein LD, Cagan RH, Kligman A. Stratum corneum Lipid Removal by Surfactants: Relation to in vivo Irritation.Dermatology. 1990;181:277-283.
6.German GK, Pashkovski E, Dufresne ER. Surfactant treatments in-fluence drying mechanics in human stratum corneum. J Biomech. 2013;46:2145-2151.
7.Hoppel M, Holper E, Baurecht D, Valenta C. Monitoring the distribu-tion of surfactants in the stratum corneum by combined ATR-FTIR and tape-stripping experiments. Skin Pharmacol Physiol. 2015;28:167-175.
8.Mizutani T, Mori R, Hirayama M, et al. Sodium lauryl sulfate stim-ulates the generation of reactive oxygen species through interac?tions with cell membranes. J Oleo Sci. 2016;65:993-1001.
9.Barba C, Semenzato A, Baratto G, Coderch L. Action of surfac?tants on the mammal epidermal skin barrier. Giorn Ital Dermat V. 2019;154:405-412.
10.Tavaszi J, Budai P. The use of HET-CAM test in detecting the ocular irritation. Commun Agr Appl Biol Sci. 2007;72:137-141.
11.Mehling A, Kleber M, Hensen H. Comparative studies on the ocu?lar and dermal irritation potential of surfactants. Food Chem Toxicol. 2007;45:747-758.
12.Mao G, Flach CR, Mendelsohn R, Walters RM. Imaging the distri-bution of sodium dodecyl sulfate in skin by confocal Raman and infrared microspectroscopy. Pharm Res-dordr. 2012;29:2189-2201.
13.Wilhelm K-P, Cua AB, Wolff HH, Maibach HI. Surfactant-induced stratum corneum hydration in vivo. prediction of the irritation po-tential of anionic surfactants. J Invest Dermatol. 1993;101:310-315.
14.Gabard B, Chatelain E, Bieli E, Haas S. Surfactant irritation: in vitro corneosurfametry and in vivo bioengineering. Skin Res Technol. 2001;7:49-55.
15.Vyumvuhore R, Tfayli A, Manfait M, Baillet-Guffroy A. Vibrational
spectroscopy coupled to classical least square analysis, a new ap-proach for determination of skin moisturizing agents\" mechanisms. Skin Res Technol. 2014;20:282-292.
16.Choe CS, Lademann J, Darvin ME. Gaussian-function-based decon-volution method to determine the penetration ability of petrolatum oil into in vivo human skin using confocal Raman microscopy. Laser Phys. 2014;24:105601.
17.Choe CS, Schleusener J, Lademann J, Darvin ME. Keratin-water- NMF interaction as a three layer model in the human stratum corneum using in vivo confocal Raman microscopy. Sci Rep. 2017;7:15900.
18.Vyumvuhore R, Tfayli A, Duplan H, Delalleau A, Manfait M, Baillet- Guffroy A. Effects of atmospheric relative humidity on Stratum Corneum structure at the molecular level: ex vivo Raman spectros-copy analysis. Analyst. 2013;138:4103.
19.Quatela A, Miloudi L, Tfayli A, Baillet-Guffroy A. In vivo Raman mi-crospectroscopy: intra- and intersubject variability of stratum cor- neum spectral markers. Skin Pharmacol Physiol. 2016;29:102-109.
20.Choe CS, Lademann J, Darvin ME. A depth-dependent profile of the lipid conformation and lateral packing order of the stra?tum corneum in vivo measured using Raman microscopy. Analyst. 2016;141:1981-1987.
21.Vyumvuhore R, Tfayli A, Piot O, Guillou ML, Guichard N, Manfait M. Raman spectroscopy: in vivo quick response code of skin physiolog?ical status. J Biomedl Opt. 2014;19:111603.
22.Quatela A, Tfayli A, Baillet-Guffroy A. Examination of the effect of Stratum Corneum isolation process on the integrity of the barrier function: a confocal Raman spectroscopy study. Skin Res Technol. 2016;22:75-80.
23.Yanase K, Hatta I. Disruption of human stratum corneum lipid struc-ture by sodium dodecyl sulfate. Int J Cosmetic Sci. 2017;40:44-49.
24.Saad P, Flach CR, Walters RM, Mendelsohn R. Infrared spectroscopic studies of sodium dodecyl sulphate permeation and interaction with stratum corneum lipids in skin. Int J Cosmetic Sci. 2012;34:36-43.
25.Caspers PJ, Nico C, Schut TCB, et al. Method to quantify the in vivo skin penetration of topically applied materials based on con- focal Raman spectroscopy. Transl Biophotonics. 2019; https://doi. org/10.1002/tbio.201900004
26.Eklouh-Molinier C, Gaydou V, Froigneux E, et al. In vivo confo- cal Raman microspectroscopy of the human skin: highlighting of spectral markers associated to aging via a research of correlation
27.Ozawa T, Endo K, Masui T, Miyaki M, Matsuo K, Yamada S.Advantage of sodium polyoxyethylene lauryl ether carboxylate as a mild cleansing agent. J Surfactants Deterg. 2016;19:785-794.
28.Seweryn A. Interactions between surfactants and the skin – theory and practice. Adv Colloid Interfac. 2018;256:242-255.
来源:荣格-《国际个人护理品生产商情》
原创声明:
本站所有原创内容未经允许,禁止任何网站、微信公众号等平台等机构转载、摘抄,否则荣格工业传媒保留追责权利。任何此前未经允许,已经转载本站原创文章的平台,请立即删除相关文章。